Jak wszyscy wiemy, produkty urządzeń medycznych różnią się od innych urządzeń automatycznych lub przemysłowych, a kraj ma surowe standardy kontroli. Shenzhen EMAR Precision Technology, który jest zaangażowany w precyzyjną obróbkę części medycznych, dzieli się z Tobą standardami produkcji produktów wyrobów medycznych. Spójrzmy razem.
1,Organ udzielający homologacji: Przedsiębiorstwa zaangażowane w eksploatację wyrobów medycznych klasy II i III zgłaszają się do Wojewódzkiej Administracji Leków w celu przeglądu i zatwierdzenia oraz otrzymują "Licencję Operacji Wyrobów Medycznych Enterprise".
1. Przedsiębiorstwa własności województwa (zarejestrowane w Wojewódzkiej Administracji Przemysłu i Handlu) są bezpośrednio akceptowane przez Wojewódzką Administrację Leków; 2. Inne przedsiębiorstwa i jednostki są akceptowane i kontrolowane wstępnie przez departamenty regulacji leków każdego miasta. Jeżeli przejdą inspekcję, pisemną opinię o akceptacji sporządza się, a wstępną opinię z inspekcji podpisuje się w formularzu przeglądu przed przedłożeniem do wojewódzkiego biura nadzoru jakości do zatwierdzenia.
Materiały deklaracyjne:
1. Jeden raport z wniosku;
2. Wypełnić trzy kopie formularza zgłoszenia o Licencję Biznesową Wyrobów Medycznych (fotokopie są nieważne);
3. jedną kopię statutu spółki oraz najnowszego sprawozdania z weryfikacji kapitału (w celu wymiany certyfikatu należy podać bilans i sprawozdanie zysków spółki);
4. Jedna kopia streszczenia samoobserwacyjnego przedsiębiorstwa (zgodnie z wymogami "Zasad wdrażania w zakresie uznawania kwalifikacji przedsiębiorstw eksploatacyjnych wyrobów medycznych w prowincji Guangdong" oraz "Standardy jądrowe, wymiany i akceptacji prowincji Guangdong");
5. wykaz personelu technicznego i konserwacyjnego wraz z jedną kopią świadectwa ukończenia studiów i jedną kopią świadectwa tytułu zawodowego (pieczętowaną urzędową pieczęcią jednostki);
6. jedną kopię świadectwa własności nieruchomości lub umowy najmu oraz planu podłogi dla pomieszczeń operacyjnych i magazynowych;
7. Jeden szczegółowy pisemny wstępny raport z recenzji i akceptacji miejskiej administracji leków (z wyłączeniem przedsiębiorstw prowincjonalnych);
8. Jedna kopia certyfikatu wstępnej rejestracji nazwy firmy lub kopii "Licencji na działalność korporacyjną";
9. Różne zasady i przepisy dotyczące zarządzania. a. odpowiedzialność za jakość i system weta; b. system akceptacji magazynu, składowania i kontroli wychodzącej; c. system analizy jakości i informacji zwrotnych; d. system zarządzania ważnością; e. system zarządzania jakością sprzedaży dla sklepów detalicznych; f. System zarządzania specjalnymi i importowanymi wyrobami medycznymi; g. system obsługi posprzedażnej (instalacja, szkolenia techniczne, konserwacja, naprawa itp.); h. system śledzenia jakości i zgłaszania działań niepożądanych dla implantowanych i specjalnych wyrobów medycznych; i. Zwrot, niezgodność, data ważności lub usunięcie systemu raportów przetwarzania wyrobów medycznych; j. system zarządzania zdrowiem;
10. Oświadczenie o własnej pewności dotyczące autentyczności dostarczonych informacji.
Proces zatwierdzania
1. Prowincjonalne biuro regulacji leków może przyjmować wnioski tylko wtedy, gdy materiały aplikacji są kompletne i spełniają wymagania procesu zatwierdzania. Obsługa organizuje odpowiedni personel lub powierzy miejskiemu departamentowi regulacji leków przeprowadzenie akceptacji na miejscu w ciągu 15 dni roboczych od daty przyjęcia, zgodnie z zasadami wdrożenia kwalifikacji przedsiębiorstw eksploatujących wyroby medyczne w prowincji Guangdong. Treść akceptacji obejmuje: biuro, biznes, magazyny i miejsca konserwacji, sprzęt testowy i konserwacyjny oraz dokumentację instalacji i konserwacji, wdrożenie systemu jakości, personel techniczny na służbie, przepisy i zasady dotyczące rodzajów eksploatowanych wyrobów medycznych oraz zbieranie i konserwację wyrobów medycznych, normy jakości dla rodzajów eksploatowanych wyrobów medycznych, certyfikaty rejestracji produktów medycznych i inne istotne materiały.
2. Osoby, które przejdą akceptację na miejscu, wypełniają formularz homologacji wyrobu medycznego w ciągu dziesięciu dni roboczych, przedstawiają wstępne opinie przeglądowe oraz składają zgłoszenie kierownikom działu i biura w celu zatwierdzenia zgodnie z procedurami.
4,Wymagania dotyczące materiałów deklaracyjnych
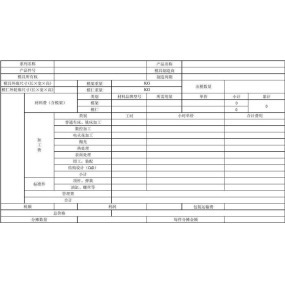
1. Raport z aplikacji powinien zawierać: ekonomiczny charakter przedsiębiorstwa, wprowadzenie głównej osoby odpowiedzialnej, ustawienie działu, ustawienie oddziału, główne obszary biznesowe i główne cele sprzedaży, główne odmiany biznesowe, specyfikacje, obiekty magazynowe i otoczenie.
2. Wykaz personelu technicznego i konserwacyjnego: odnosi się do personelu technicznego w dziedzinie nauki i inżynierii, medycyny, farmacji i inżynierii. Wymagane jest wymienienie imienia i nazwiska, płci, wieku, końcowej szkoły ukończenia studiów, wykształcenia, kierunku, tytułu technicznego, stanowiska firmy i numeru dowodu tożsamości.
3. Plan obiektów eksploatacyjnych i magazynowych: Obiekty eksploatacyjne i magazynowe powinny wskazywać ich długość, szerokość (metry), układ, umieszczenie półki, lokalizację sprzętu przeciwpożarowego oraz pięć urządzeń zapobiegawczych.
4. Wszystkie materiały zgłoszeniowe muszą być drukowane na papierze A4 i opatrzone pieczęcią urzędową przedsiębiorstwa, jednostki lub nadzorczej jednostki. Nazwa przedsiębiorstwa musi być dostarczona kopią świadectwa rejestracji gospodarczej lub licencji gospodarczej osoby prawnej, a także kopie certyfikatu ukończenia studiów personelu technicznego i konserwacyjnego, certyfikatu tytułu zawodowego itp. Jednostka wnioskująca powinna wskazać na kopiach, że:; Kopia pasuje do oryginału; Słowa te są opatrzone pieczęcią urzędową i związane w kolejności książki.
5,Inne sprawy
Przedsiębiorstwa i jednostki powinny przestrzegać powyższych procedur zatwierdzania i wymogów deklaracji. Surowo zabronione jest przekazywanie darów mienia personelowi obsługującemu. Jeśli ktoś zażąda lub przyjmuje mienia, prosimy o zgłoszenie się do Urzędu Nadzoru Wojewódzkiej Administracji Leków.


 English
English Spanish
Spanish Arabic
Arabic French
French Portuguese
Portuguese Belarusian
Belarusian Japanese
Japanese Russian
Russian Malay
Malay Icelandic
Icelandic Bulgarian
Bulgarian Azerbaijani
Azerbaijani Estonian
Estonian Irish
Irish Persian
Persian Boolean
Boolean Danish
Danish German
German Filipino
Filipino Finnish
Finnish Korean
Korean Dutch
Dutch Galician
Galician Catalan
Catalan Czech
Czech Croatian
Croatian Latin
Latin Latvian
Latvian Romanian
Romanian Maltese
Maltese Macedonian
Macedonian Norwegian
Norwegian Swedish
Swedish Serbian
Serbian Slovak
Slovak Slovenian
Slovenian Swahili
Swahili Thai
Thai Turkish
Turkish Welsh
Welsh Urdu
Urdu Ukrainian
Ukrainian Greek
Greek Hungarian
Hungarian Italian
Italian Yiddish
Yiddish Indonesian
Indonesian Vietnamese
Vietnamese Haitian Creole
Haitian Creole Spanish Basque
Spanish Basque